随着环境保护事业的迅速发展,人们对湿地功能也有了广泛的认识。湿地作为“地球之肾”,担负着对地球自然水体的净化和处理功能。由于城市中天然湿地的逐渐减少和消亡,因此,人工湿地以其独到的优越性受到了越来越多的关注和发展。
近年来,宁夏人工湿地的数量和面积不断增加,如沙湖、阅海、鸣翠湖等景观湖泊已成为重要的风景区。同时,宁夏境内的人工湿地也存在富营养化的趋势,人工种植芦苇、香蒲等水生植物,既能满足湿地造景的需要,也能降低水体中的氮磷等营养盐的含量,可谓一举两得。芦苇、香蒲是宁夏银川平原本土植物,具有短期成型及快速成景等优点。
芦苇是湿地常见的挺水植物,为被子植物门单子叶植物纲禾本科水生植物。芦苇多生于低湿地或浅水中,生长在灌溉沟渠旁、河堤沼泽地、河溪边等多水地区。芦苇植株高大,地下有发达的匍匐根状茎,繁殖力强,生物量大,具有很强的环境适应能力,可以适应比较恶劣的环境条件。芦苇对多种污染物抗性强,具有很好的水质净化作用,在湿地生态系统中发挥着重要作用,因而成为湿地种植的水生植物的优先选择。自然生长的芦苇,以种子和根状茎繁殖。在造景绿化过程中,由于水生植物恢复生长要求较高,受环境制约因素较多,所有大多采用人工采挖及移栽的办法,目前,尚缺乏简便易行成本低廉的快速繁殖的方法。因此,探索芦苇的组培育苗方法是非常有必要的。组培技术的应用很广泛,很多种植物都实现了利用组培育苗的方法进行快繁。叶保君等在花叶芦竹组培试验中取材为秋季植物茎秆的侧芽为外植体,取材受季节和材料的限制,在春季不能进行有效组培快繁。本试验就茎段作为外植体,取材方便,不受季节限制,筛选合适的培养基和激素配比浓度使茎段在节处产生侧芽,进而生出新根形成组培苗,建立和优化芦苇的组培快繁技术体系,以期为芦苇的组培快繁生产提供操作流程和数据参考,为批量生产芦苇组培苗并应用于人工湿地建设和园林水景建设提供理论依据。
1 材料与方法
1.1 材料
取芦苇叶片、节间、节作为不同的外植体;选取1/2MS、MS、N6培养基作为培养基质。植物生长激素为6-BA、NAA、IBA。
1.2 方法
1.2.1 培养基的筛选 取夏季芦苇叶片,用清水冲洗干净,剪切成大小一致的小片,按如下方法消毒:(1)用无菌水洗3次;(2)用70%乙醇消毒30 s,无菌水冲洗3次;(3)0.1%氯化汞消毒5 min,无菌水冲洗5次[9],冲洗过的外植体放在已灭菌的滤纸上吸干水分,然后分别接种到1/2MS、MS、N6 3种培养基上,控制环境条件,培养温度(25±2)℃,光照时间为12 h/d(下同),光强1 500~2 000 lx,光照12 h/d。在此条件下培养,观察其生长状况。
1.2.2 外植体的筛选 取芦苇的叶片、带节的茎段分别作为不同的外植体,按如下方法消毒:(1)用无菌水洗3次;(2)用70%乙醇消毒30 s,无菌水冲洗3次;(3)0.1%氯化汞消毒5 min,无菌水冲洗5次,冲洗过的外植体放在已灭菌的滤纸上吸干水分,分别接种到1/2MS培养基上,控制环境条件,培养温度(25±2)℃,光强1 500~2 000 lx,光照12 h/d。在此条件下培养,观察其生长状况。
1.2.3 外植体消毒方法的筛选 取夏季芦苇带节的茎段,用清水冲洗干净,剪切成大小一致小节,按如下方法消毒:(1)用无菌水洗3次,用70%乙醇消毒30 s,无菌水冲洗3次,再用0.1%氯化汞消毒5 min,无菌水冲洗5次。(2)用无菌水洗3次,用70%乙醇消毒40 s,无菌水冲洗3次,再用0.1%氯化汞消毒7 min,无菌水冲洗5次。(3)用无菌水洗3次,用70%乙醇消毒20 s,无菌水冲洗3次,再用0.1%氯化汞消毒3 min,无菌水冲洗5次。
冲洗过的外植体放在已灭菌的滤纸上吸干水分。以上3组处理材料分别接种在1/2MS培养基上,控制环境条件,培养温度(25±2)℃,光强1 500~2 000 lx,光照12 h/d。在此条件下培养,观察其生长状况。
1.2.4 不同浓度激素配比对芦苇侧芽分化的影响 取芦苇茎秆,在节间处剪断,剪成长约1.5 cm的小段。把节段放入烧杯中用自来水冲洗数次,再倒入70%乙醇的烧杯中洗30 s,无菌水冲洗3次,再放入0.1%氯化汞中洗5min,无菌水冲洗5次。把已经冲洗好的节段放在已经灭菌的滤纸上吸干水分,备用。把准备好的材料接种在含有不同浓度激素的上述培养基上。控制环境条件,培养温度(25±2)℃,光强1 500~2 000 lx,光照12 h/d。在此条件下培养,观察节段的侧芽生长情况。
1.2.5 不同浓度激素配比对芦苇生根的影响 取芦苇茎秆,在节间处剪断,剪成长约1.5 cm的小段。把节段放入烧杯中用自来水冲洗数次,再倒入70%乙醇的烧杯中洗30 s,无菌水冲洗3次,再放入0.1%氯化汞中洗5 min,无菌水冲洗5次。把已经冲洗好的节段放在已经灭菌的滤纸上吸干水分,备用。把准备好的材料接种在含有不同浓度激素的上述培养基上。控制环境条件,培养温度(25±2)℃,光强1 500~2 000 lx,光照12 h/d。在此条件下培养,观察外植体的生根情况。
2 结果与分析
2.1 不同培养基对外植体生长的影响
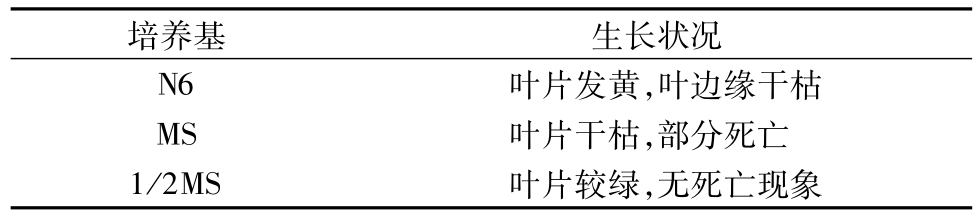
以芦苇叶片为材料,在相同培养条件下3种培养基中的的生长情况见表1。结果表明,1/2MS培养基中的生长情况比其他2种培养基的培养效果好,叶片相对较绿,短期内无外植体死亡现象。N6、MS中外植体均出现叶片干枯发黄,可能原因是其培养基中大量元素的浓度过大,使植物细胞的外压过大,植物细胞失水死亡。表明1/2MS培养基中的离子浓度更适合芦苇外植体生长。
表1 不同培养基上芦苇外植体生长状况
2.2 外植体的筛选
在节间、带节的茎段、叶片3种不同的外植体中,只有带节的茎段可以长出侧芽,节间、叶片均无分化现象,没有愈伤组织产生,原因可能是芦苇节中存在居间分生组织,有利于形成愈伤组织,有利于侧芽分化。
2.3 不同消毒方法对外植体生长的影响
从表2可以看出,70%乙醇30 s、0.1%氯化汞5min的消毒效果佳。氯化汞本身是剧毒品,尽管使用时稀释到很低的浓度,对于植物细胞来说还是有很大伤害,所以其清洗时间不宜过久,但时间过短又达不到消毒的效果。每次氯化汞消毒完毕,要用无菌水冲洗5次左右,保证外植体清洗干净。
表2 不同消毒方法对芦苇外植体生长的影响

2.4 不同浓度激素配比对芦苇侧芽分化的影响
把芦苇茎段材料接种在含有不同浓度激素的培养基上进行培养,培养期间每天进行观察,以培养25 d观察结果进行分析。
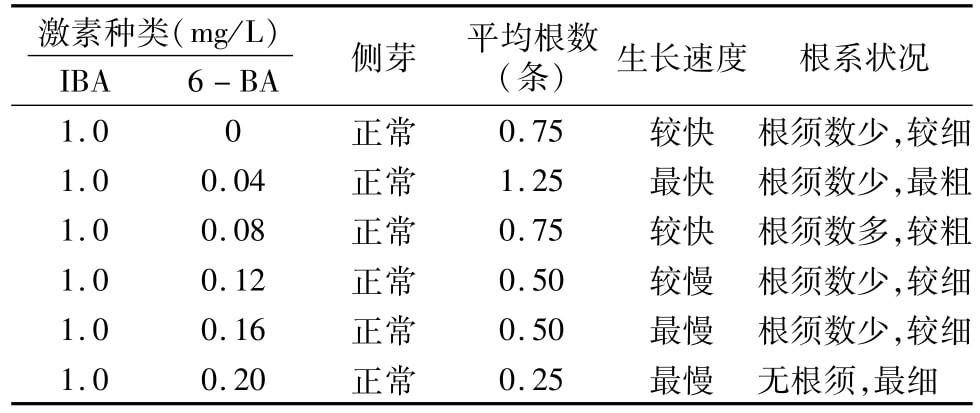
从表3可以看出,NAA浓度在0.3~0.5 mg/L之间,6-BA浓度在0.6~1.0 mg/L都可以长出侧芽,效果好的是NAA 0.4 mg/L+6-BA 0.6~0.8 mg/L的浓度配比。2.5 不同浓度激素配比对芦苇生根的影响
表3 不同激素浓度配比对芦苇侧芽生长的影响
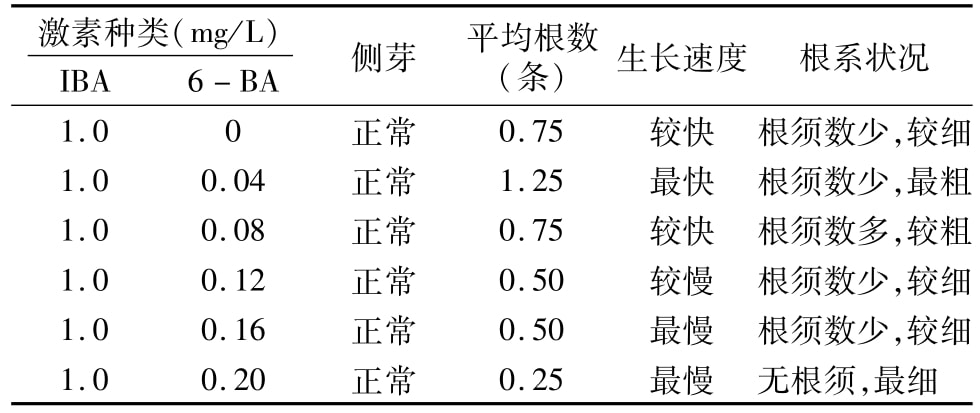
在IBA浓度为1.0 mg/L、6-BA浓度为0~0.20 mg/L时均有生根现象发生,生根状况佳的浓度配比是IBA 1.0 mg/L、6-BA 0.04 mg/L(表4)。在此生根条件下,所有节段均可产生侧芽,并可在侧芽生出15 d左右出现生根现象,即在这个浓度配比下,外植体均是先分化长出侧芽,然后在侧芽上长出新根。
表4 不同激素浓度配比对芦苇生根的影响
2.6 培养基的简化
为了降低成本以利于今后生产推广,本研究在原培养基的基础上,进行简化试验,将配制培养基的蒸馏水改用自来水,培养基中的蔗糖成分均可改为白砂糖,但需适当加量,试验结果无明显差异。高压锅对试验器具的灭菌时间可由原来的40 min减少至20 min,对试验结果无影响。
2.7 芦苇组培苗的移栽
当组培苗长到6~7 cm的时候,根系能主动吸收环境中的营养和水分,可以进行移栽。把组培苗移栽到含有腐殖质和沙土的花盆里,注意保湿保温和光照。
3 讨论与结论
从本试验结果来看,对于外植体的选择,用带节的茎段作外植体,有利于长出侧芽的激素配比为NAA 0.4 mg/L+6-BA 0.6~0.8 mg/L。
有关芦苇快速繁殖技术的研究中还没有组织培养方面的报道,本试验对芦苇的快繁技术进行了研究。促进侧芽分化的培养基和促进生根的培养基在激素配比上差异较大,在侧芽分化后,转移到生根培养基的过程中,污染严重且过程不易操作,试验结果表明,在IBA浓度为1.0 mg/L、6-BA的浓度为0~0.20 mg/L时,外植体均有生根现象发生,生根状况佳的是浓度配比为IBA 1.0 mg/L、6-BA 0.04 mg/L。避免了在侧芽长出后更换培养基的步骤,使过程更为简单容易操作。当试管苗长到6~7 cm的时候,根系就能主动吸收外界环境中的营养和水分,这时可以进行移栽,把试管苗移栽到含有腐殖质和沙土的花盆里,注意保湿保温和光照,试管苗生长状况良好。移栽后炼苗和移栽大田的管理过程还需进一步试验研究。
版权声明:文章来源于http://www.zupei17.com/news/detail/id/434.html,转载请注明出处!
上一个:金线莲组培快繁技术研究
下一个:铁皮石斛组培体系的建立