柳枝稷为多年生草本C4植物,在北美洲广泛种植。柳枝稷植株高大,具有根系发达、防风固沙能力强、耐瘠薄等优点,是沙漠绿化的理想植物。柳枝稷可合成燃料乙醇、甲醇、沼气、氢气等,由于其能源产出率高,在乙醇生产过程中易降解,被美国政府确定为替代玉米生产燃料乙醇的首选能源植物。保存并快速繁殖材料是现代生物育种技术的重要研究内容。研究发现,柳枝稷是一种异型杂交的多倍体单子叶植物,具有高度的自交不亲和性。因此,通过遗传转化获得具有高遗传力的柳枝稷转基因品种变得尤为重要,转基因育种的前提是建立的植物组织培养体系。现有的柳枝稷组培研究中,外植体多为叶片、茎尖、节间及幼穗,以这些材料作为外植体,愈伤诱导率普遍较低,且容易受生长周期及季节限制。本研究以柳枝稷成熟种子为材料,探索愈伤诱导过程中很好外源激素配比,从而建立柳枝稷种子组培快繁体系,旨在为开发利用柳枝稷资源提供依据。
1 材料与方法
1.1 材料
柳枝稷品种为Alamo(北京市农林科学院),用自来水冲洗脱壳后的成熟种子,去掉杂质,用无菌水浸泡12 h,冲洗后风干,置于4℃冰箱中备用。
1.2 方法
1.2.1 培养基配制 愈伤组织诱导及分化以MS为基础培养基,采用3因素3水平进行试验(表1),pH值为8.0。生根培养基为 1/2MS+NAA(0.4、0.8、1.2、1.6 mg/L)+3% 蔗糖+0.75% 琼脂,pH值为8.0。配制完成后,121℃高压灭菌15 min,待温度冷却至50~60℃时摇匀,倒入培养皿中,置于超净台风干备用。
1.2.2 种子处理 挑选干燥饱满的种子,首先用6%NaClO溶液消毒2.5 h,轻轻搅动使NaClO与种子充分接触,然后用无菌水清洗3~5遍,浸泡12 h。之后用6%NaClO溶液消毒20 min,用无菌水清洗种子3~5遍。在无菌条件下,将处理好的种子接种到愈伤诱导培养基中进行培养。
1.2.3 培养条件 选择同一批成熟种子作为外植体进行愈伤组织诱导及分化试验,每处理重复5次,每个培养皿中接种30粒种子,置于光照培养箱中培养。培养30~45 d后,选择株高为2~4 cm的再生苗,切下幼苗转入生根培养基中,继续置于光照培养箱中培养,每个组培瓶接种12个外植体,每浓度重复4次,培养10~15 d。愈伤组织诱导培养基试验因素及水平见表1。GZX-300BS-4光照培养箱(上海新苗医疗器械制造有限公司)培养温度设置为24℃,光照培养时间为16 h/d,光照强度为12000 lx。
1.2.4 生长指标测定 接种后,每3 d统计1次胚芽数目、胚根出现时间及数目、愈伤组织出现时间及数目等指标。培养30~45 d后,统计种子发芽率及愈伤诱导率,确定很好愈伤组织诱导培养基激素配比。在诱导培养基上培养一段时间后观察愈伤组织的生长情况,观察并统计分化出的不定芽生长情况及数目。愈伤诱导分化培养完成后,接种到生根培养基中继续培养10~15 d,观察不同浓度NAA对再生苗生根的影响,记录生根外植体及根的数目。
表1 愈伤组织诱导培养基试验因素及水平

2 结果与分析
2.1 不同激素配比对种子萌发时间及萌发率的影响
由表2可知,培养5~7 d后,大多数种子都能在愈伤组织诱导培养基上萌发,且不同浓度激素对柳枝稷种子的萌发时间及萌发率均有显著影响。当2,4-D浓度为6 mg/L、6-BA 浓度为1.0 mg/L、NAA 浓度为0.6 mg/L 时,种子接种后3 d即开始萌发,萌发率达82%。当2,4-D浓度为6 mg/L、6 -BA 浓度为1.5 mg/L、NAA 浓度为 1.2 mg/L 时,种子萌发时间延迟,接种后7 d才开始萌发,且萌发率仅为35%。由此可知,柳枝稷种子萌发的很好培养基为MS+2,4 - D 6 mg/L+6 - BA 1.0 mg/L+NAA 0.6 mg/L。
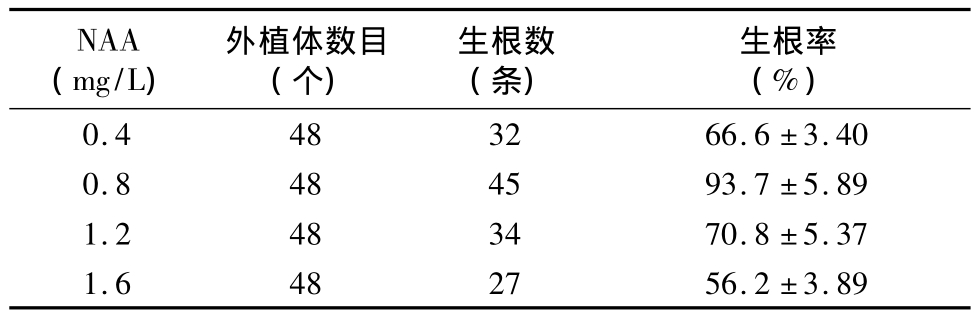
表2 不同浓度激素配比对芽形成及愈伤组织诱导的影响
注:“+++”表示愈伤组织长势很好,形成的愈伤组织数目、大小均比较理想;“++”表示长势良好;“+”表示长势一般,形成的愈伤组织数目较少,体积较小。
2.2 不同激素配比对愈伤组织诱导及分化培养的影响
经消毒处理的成熟种子培养5 d后,部分培养基上开始有愈伤组织形成,随后逐渐变大,并且随着愈伤组织的增大其表面逐渐变得干燥,质地紧密结实,颜色多为黄色、嫩绿色(图1-a)。当 2,4-D浓度为2 mg/L、6-BA浓度为0.5 mg/L、NAA 浓度为1.2 mg/L时,形成愈伤组织所需的时间很长,即培养12 d后才能观察到愈伤组织的形成。不同激素配比下,外植体愈伤组织的长势也有显著差别(图1-b)。在愈伤诱导培养基上培养25 d后,不同激素配比处理下愈伤组织在色泽、大小等指标方面差异较大,愈伤诱导率很高可达82%,很低仅为35%(表2)。一部分愈伤组织色泽淡黄,体积较小且表面干燥疏松;另一部分愈伤组织色泽嫩绿,体积较大且表面紧实,具有较强的再分化能力,可用于诱导成苗。这些生长状态良好的愈伤组织培养一段时间后体积逐渐增大,且伴随出现一些白色颗粒状胚状体。继续培养10 d后,有些原本白色的胚状体凸起,分化为嫩绿色的幼芽(图1-c)。随着培养时间的延长,新形成的幼芽逐渐变绿,并且直立生长,有的幼芽长势较快,接种到培养基上15 d后可长至2~3 cm。体积较小的愈伤组织接种一段时间后,分化出一些零星的幼芽,随后幼芽停止生长。将切割后的分化组织接种到新培养基上培养20 d,有的芽能长出长约4~6 cm的新叶,并从嫩绿色变成翠绿色(图1-d)。愈伤组织诱导及分化的很好培养基为 MS+6 mg/L 2,4-D+1 mg/L 6-BA+0.6 mg/L NAA+3% 蔗糖 +0.75% 琼脂,pH值为8.0。
2.3 不同浓度NAA对不定芽生根的影响
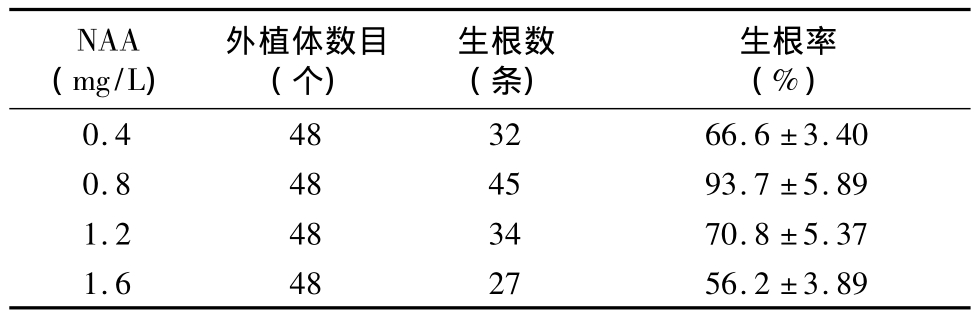
在愈伤组织诱导及分化的很好培养基上培养40 d后,愈伤组织开始分化出大小不一的不定芽。选择长势较一致的不定芽切割后接种到含有不同浓度NAA的生根培养基上进行生根诱导(图1-e)。结果表明,当 NAA浓度为 0.8 mg/L时,生根时间很短,7 d后即可观察到白色凸起并逐渐形成新根,生根率可达90%以上(表3),每棵再生苗均能诱导出15~20条新生根(图1-f)。当NAA浓度过低(0.4 mg/L)或者过高(1.6 mg/L)时,新根都会延迟出现。在生根的同时,新生苗新叶长势良好(图1-g),平均长约10 cm,部分甚至高达20 cm(图1-g)。
表3 不同浓度NAA对不定芽生根率及生根数目的影响
2.4 炼苗
当大部分新生苗长出数量不一的新根后,将组培瓶上的封口膜去掉,继续在培养箱中培养2~3 d,随后将培养基取出置于室温下培养,并在培养基表面加入少许无菌水,继续培养3 d后,将新苗从培养基中轻轻取出,避免损伤根部。用无菌水将幼苗表面的培养基冲洗干净,移栽至花盆中继续培养,用塑料薄膜覆盖以防止水分大量流失。每天用无菌水浇洒新苗,待新苗长势稳定后,将花盆搬至室外继续培养炼苗(图1-h)。当培养条件适合时,大部分幼苗都能正常存活,并且稳定生长(图1-i)。
3 结论
研究发现,2,4-D、TDZ结合使用对柳枝稷愈伤组织的形成起促进作用。认为,添加不同浓度的2,4-D及6-BA对柳枝稷的愈伤诱导、分化再生有明显影响。传统的柳枝稷组培步骤较繁琐,包括愈伤诱导、继代、分化及生根等环节,耗时较长,且产率较低。利用柳枝稷成熟种子作为外植体进行愈伤组织的诱导及分化,研究灭菌处理及不同浓度激素组合对愈伤组织诱导及分化的影响,包括愈伤组织诱导、分化、生根等环节,耗时较长。在愈伤诱导过程中,添加一定浓度的6-BA可改变愈伤组织的质量,提高植物分化再生频率。有研究表明,2,4-D对愈伤组织形成有比较明显的促进作用,很少被植物细胞所代谢,且不同浓度的2,4-D与其他一些细胞分裂素结合,可以建立组培体系。NAA是广谱型植物生长调节剂,能促进细胞分裂和扩大,诱导分化组织形成不定根。本研究表明,不同浓度配比的激素愈伤诱导率差异较大,以MS培养基为基本培养基,添加 6 mg/L 2,4-D、1 mg/L 6-BA、0.6 mg/L NAA进行愈伤组织诱导,愈伤诱导率可高达82%。愈伤组织诱导增殖后,在很好激素配比培养基上可直接进行分化培养,能进一步分化出大量新生芽。本方法有效缩短了再生时间,节约了试验成本,提高了效率。室内炼苗7 d后,将柳枝稷新生苗移至室外培养,可正常存活
版权声明:文章来源于http://www.zupei17.com/news/detail/id/451.html,转载请注明出处!
上一个:恒温恒湿空调机组配置
下一个:空气凤梨组培快繁技术优化