本研究通过组织培养,对叶下珠进行芽的诱导、增殖、生根和炼苗移栽等,建立了一套完整的叶下珠组培快繁体系,为叶下珠大规模繁殖提供技术参考。
1 材料与方法
1.1 材料
福建省厦门市福建省亚热带植物研究所内种植的叶下珠Phyllanthus urinaria。
1.2 方法
1.2.1 培养条件 基本培养基为 MS,琼脂 7.5 g·L-1,蔗糖为 30 g·L-1,pH 5.8~6.0。培养温度(25 ± 1) ℃,光照时间12 h·d -1,光照强度1000~1500 lx。
1.2.2 外植体接种 选取长势均匀的叶下珠植株,用剪刀剪取位于植株中部的茎段,去除叶片与假叶柄。加1~2滴洗洁精将茎段表面洗刷干净,流水冲洗5~6 h。于超净工作台上用75%酒精浸泡30 s,然后用0.1%升汞消毒13 min,无菌水冲洗5~6次,并用无菌滤纸擦干,置于接种盘上。用手术刀将外植体切成1.5~2 cm带节茎段,生物学顶端朝上接种于培养基上。
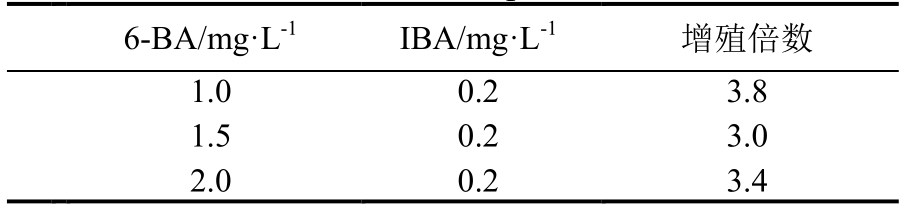
1.2.3 生长调节剂配比试验 将消毒外植体接种到按单因素多水平设计的不同生长调节剂配比的、添加0.5 g·L-1活性炭的MS培养基中,共计7组,分别为:IBA为0.2 mg·L-1,6-BA分别为1.0、1.5、2.0、3.0 mg·L-1;6-BA 为 1.5 mg·L-1,IBA 分别为 0.1、0.2、0.5、1.0 mg·L-1 (表 1)。每组 15 瓶,每瓶接 1个外植体,每3 d观察1次,15 d统计诱导情况。
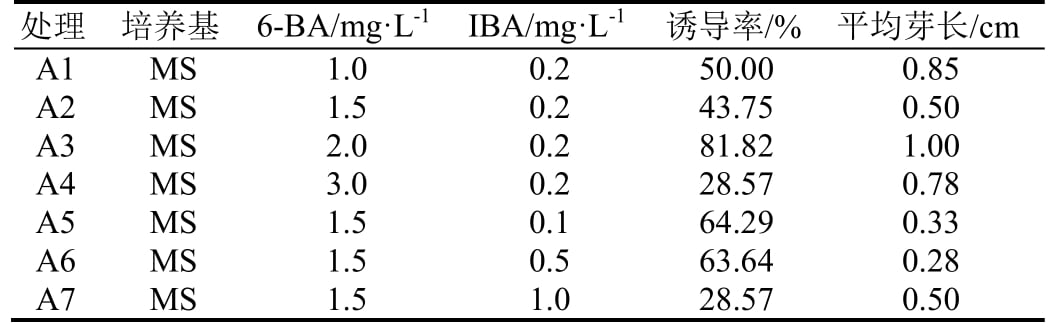
1.2.4 诱导培养基 得出芽诱导佳生长调节剂配方后,对比添加0.5 g·L-1活性炭的MS和1/2MS培养基的诱导效果,共2组,每组24瓶,每瓶接1个外植体,每4 d观察1次,20 d后统计诱导情况。
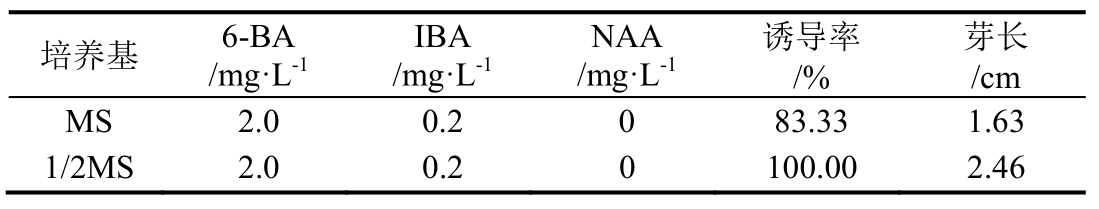
1.2.5 不同浓度6-BA对叶下珠芽的处理 将茎段诱导出的芽在超净工作台上切成1.5~2 cm带芽茎段,接种至添加不同浓度6-BA的培养基中,共计3组,每处理5瓶,每瓶2个,即每处理10个外植体,每5 d观察1次,25 d后统计芽增殖情况。
1.2.6 不同浓度NAA与IBA对丛生芽的处理 将增殖扩繁的丛生芽在超净工作台上分成单个芽,接种至添加蔗糖20 g·L-1的不同培养基中,共计6组,每处理5瓶,每瓶10个芽,即每处理50个芽,每5 d观察1次,25 d后统计生根、长势情况。
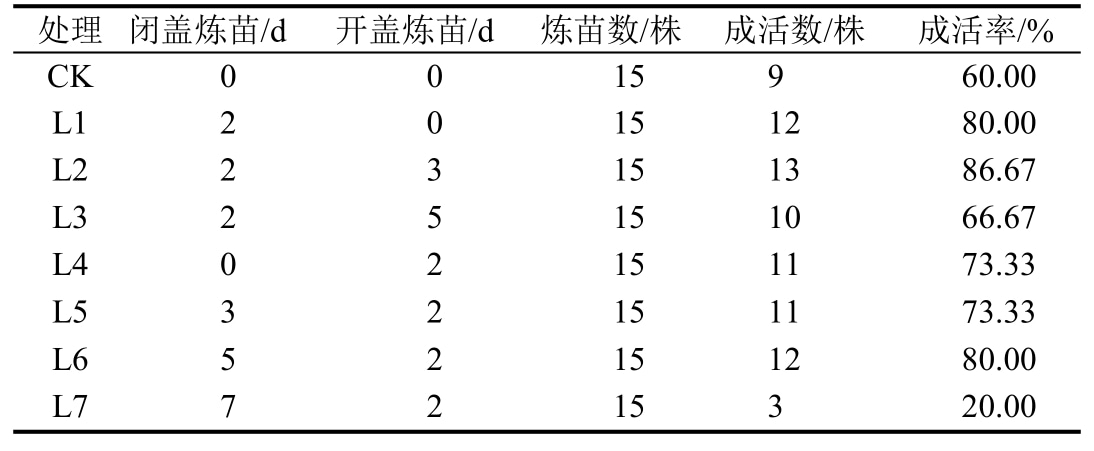
1.2.7 炼苗 将生根的瓶苗转移至培养室外进行炼苗,处理时间设置见表5。炼苗后清水洗净根部培养基,移栽至加水拌成泥状的菜园土基质。栽培条件:自然光,气温25~30 ℃。移栽15 d后统计成活率。
2 结果与分析
2.1 不同生长调节剂配比对叶下珠芽诱导的影响
从表1可知,不同浓度生长调节剂配比对叶下珠茎段诱导芽的影响效果不同。当IBA为0.2 mg·L-1时,诱导率先是随6-BA浓度升高而升高,当6-BA浓度达2.0 mg·L-1后,呈现出随6-BA浓度升高而降低的趋势。当6-BA为1.5 mg·L-1时,诱导率随IBA浓度升高呈降低的趋势。当6-BA为2.0 mg·L-1,IBA 为 0.2 mg·L-1时,诱导率高,达到81.82%,芽的平均长度长,达到1.00 cm,故该配比可作为适宜的叶下珠茎节诱导芽生长调节剂配比。
表1 生长调节剂对叶下珠芽诱导的影响
2.2 不同培养基对叶下珠芽诱导的影响
从表2可知,当生长调节剂配方同为6-BA 2.0 mg·L-1,IBA 0.2 mg·L-1时,1/2MS 培养基比MS培养基的诱导率高,达100%,平均芽长也较长,达2.46 cm。因此,较适合叶下珠茎段诱导芽的培养基配方为 1/2MS +6-BA 2.0 mg·L-1 + IBA 0.2 mg·L-1 + 琼脂7.5 g·L-1 + 蔗糖 30 g·L-1 + 活性炭 0.5 g·L-1。
表2 不同培养基对叶下珠茎段诱芽的影响
2.3 不同浓度6-BA对叶下珠芽增殖的影响
从表3可知,在相同IBA浓度下,6-BA浓度为1.0 mg·L-1时,芽平均增殖倍数达3.8,为本试验大增殖倍数,小芽长势也较好,可为后期研究提供良好的材料。因此,在本试验中适合芽增殖的培养基配方为 1/2MS + 6-BA 1.0 mg·L-1+ IBA 0.2 mg·L-1 + 琼脂7.5 g·L-1 + 蔗糖 30 g·L-1。
注:基本培养基为1/2MS。
2.4 不同浓度NAA与IBA对丛生芽生根的影响
从表4可知,NAA对叶下珠丛生芽生长、生根作用不佳。添加NAA后,植株瘦小,茎下部长满红色愈伤组织,根呈白色绒毛状。IBA对叶下珠丛生芽生长、生根有明显促进作用,在IBA为0.5 mg·L-1时,丛生芽生长快,植株绿色,较粗壮、健康,根系发达,主次根明显(图1)。但随IBA浓度增加,丛生芽植株生长变缓,主次根区别不明显。因此,较适合丛生芽生根的培养基为1/2MS + IBA 0.5 mg·L-1+ 琼脂7.5 g·L-1 + 蔗糖20 g·L-1,此时丛生芽生长快,根系发达,生根率达100.00%。
表4 不同浓度NAA与IBA对叶下珠丛生芽生根的影响
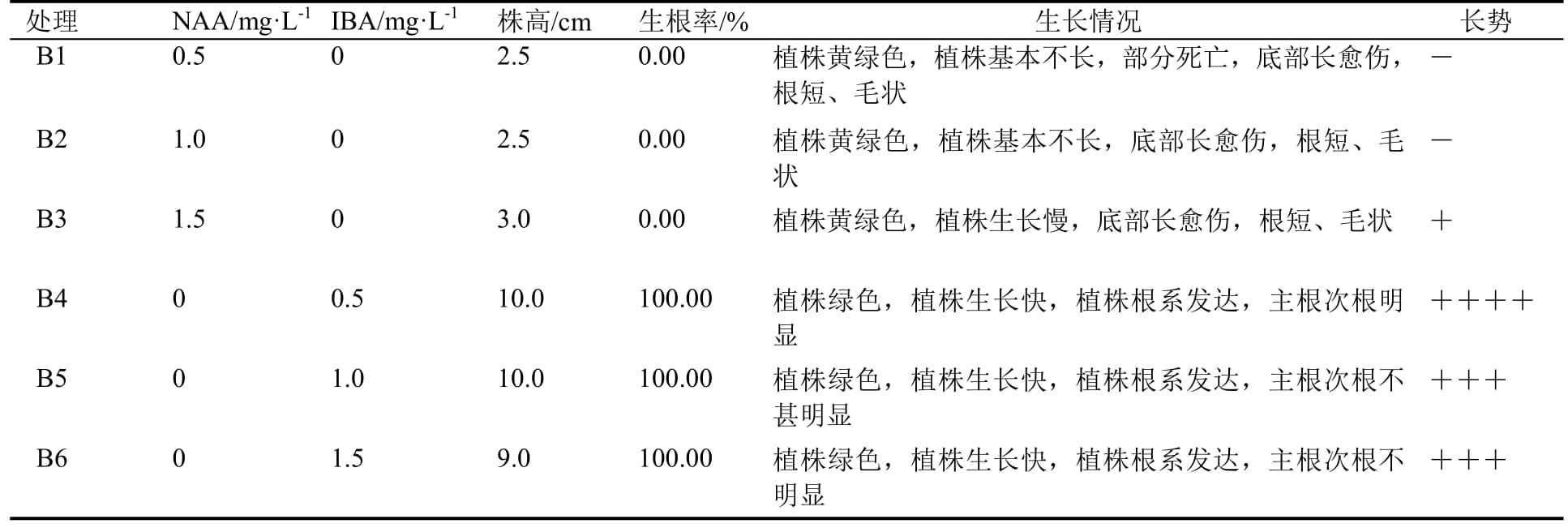
注:基本培养基为1/2MS;“-”表示差,“+”表示一般,“++”表示好,“+++”表示较好,“++++”表示好。

图1 添加IBA 0.5 mg·L-1的诱导苗长势及生根(25 d)
2.5 不同炼苗时间对叶下珠瓶苗移栽的影响
从表5可见,不经炼苗直接移栽,成活率为60.00%,经过适当炼苗可提高移栽的成活率;炼苗时间不宜太长,若开盖太长,瓶苗内的培养基长菌,对瓶苗造成伤害;若整体炼苗时间太长,瓶苗自身易失水,不利于移栽,导致成活率低。因此,较适合叶下珠组培苗的炼苗方式为室外闭盖炼苗 2 d,开盖炼苗3 d,移栽成活率达86.67%。
表5 不同炼苗时间对移栽成活率的影响
3 讨论
叶下珠的主要药理活性成分柯里拉京是一种多酚类物质,极容易氧化。在外植体诱导丛生芽的过程中,茎节的切口会分泌大量次生代谢产物,导致外植体褐化,降低组培成功率。外植体褐化程度高,需通过多次转接以避免褐化,但是多次转接易造成污染。本试验通过添加活性炭以吸收次生代谢物,抑制褐化效果良好,也减少人为操作带来的污染。
在芽增殖试验中,1.0 mg·L-1 6-BA 和0.2 mg·L-1 IBA的生长调节剂组合是较适合芽增殖的生长调节剂配比,这与研究结果相近,但他们认为芽增殖中6-BA佳浓度为2.0 mg·L-1。本研究中6-BA浓度为1.0、1.5、2.0 mg·L-1的芽增殖系数均达3倍以上,并以1.0 mg·L-1时增殖倍数大,小芽长势好。
在炼苗移栽研究中,基质为泥状菜园土。泥状土在栽培初期水分饱满,但后期易结块,对组培苗成活率造成一定影响。可适当添加一定比例的有机土进行改良,调整土壤疏松度,以利于移栽苗成活。【本文章内容来源于网络,如有侵权请告知!我们立即删除】